
中国质量新闻网讯 2022年3月31日,国家药品监督管理局食品药品审核查验中心发布《医疗器械飞行检查情况通告(2022年第3号)》。
据通告,为加强医疗器械监督管理,保障医疗器械安全有效,依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《药品医疗器械飞行检查办法》《医疗器械生产质量管理规范》及相关附录,以及《食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监〔2015〕218号)等要求,按照国家药品监督管理局2021年医疗器械检查工作部署,核查中心于2021年10月-12月组织开展了医疗器械生产企业飞行检查工作,发现湖南英和康元生物工程有限公司存在不符合项16项,其中关键不符合项12项,一般不符合项4项。
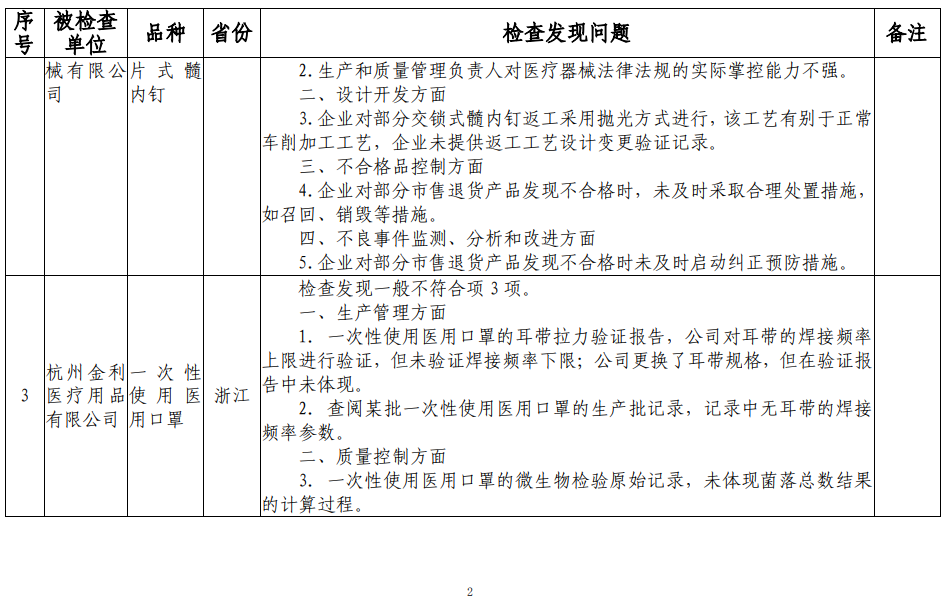
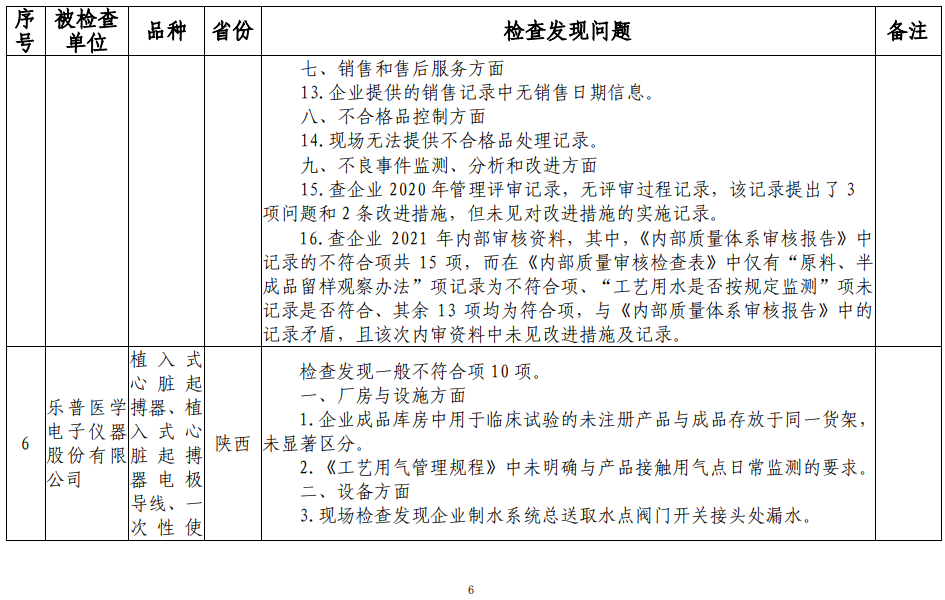
检查还发现,上海科玛嘉微生物技术有限公司存一般不符合项5项;常州市康辉医疗器械有限公司存一般不符合项5项;杭州金利医疗用品有限公司存一般不符合项3项;新乡市宏达卫材有限公司存一般不符合项8项;乐普医学电子仪器股份有限公司存一般不符合项10项;重庆华伦医疗器械有限公司存一般不符合项6项。
针对检查中发现的不符合要求问题,请相关省、自治区、直辖市药品监督管理局督促企业按要求整改,要求企业评估产品安全风险,对存在安全风险的,应按照《医疗器械召回管理办法》召回相关产品。企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。









 您当前位置:
您当前位置:





